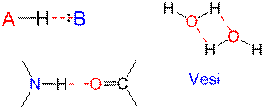
Kemiallisten sidosten (kovalenttinen ja ionisidos) lisäksi on olemassa molekyylien välisiä heikompia vuorovaikutuksia (vetysidos, ioni-dipoli -sidos, dipoli-dipoli -sidos ja van der Waals -sidos), joilla kaikilla on osuutensa aineominaisuuksien muodostumisessa.
Vetysidoksen asema luonnossa on aivan keskeinen. Se selittää veden korkean kiehumispisteen. Proteiinien ja DNA:n rakenteissa vetysidoksilla on keskeinen merkitys.
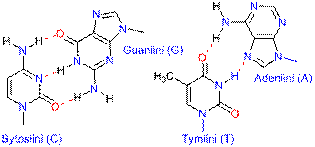
DNA:ssa emäsparit A-T ja G-C ovat kiinni toisissaan vetysidoksilla. Proteiinien laskostuminen johtuu vetysidoksista. Vetysidoksen energia (10-40 kJ mol–1) on huomattavsti pienempi kuin kovalentin tai ionisidoksen, minkä vuoksi se voi katketa jo huoneenlämmössä. Vetysidos atomien A ja B välillä voidaan esittää kaaviona:


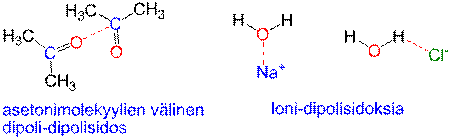
Dipoli-dipoli-sidoksessa molekyylien erimerkkisellä osittaisvarauksella varautuneet osat vetävät toisiaan puoleensa. Esimerkiksi asetonimolekyylin negatiivisen osittaisvarauksen omaava happiatomi vetää puoleensa positiivisen osittaisvarauksen omaavaa karbonyyliryhmän hiiliatomia. Vetysidos on erikoistapaus dipoli-dipoli-sidoksesta. Veden dipolimolekyylit voivat muodostaa ioni-dipoli-sidoksia ioniyhdisteiden ionien kanssa (esim. NaCl).
Kaikkien molekyylien välillä vaikuttaa erittäin lyhyen kantaman voimia, joilla atomit vetävät toisiaan heikosti puoleensa. Van der Waals vuorovaikutukset välittävät esimerkiksi useiden entsyymien ja niiden substraattien sitoutumista. Lipidimolekyylit ovat järjestäytyneet jatkuvaksi kaksoiskerrokseksi, jota pitävät koossa van der Waalsin voimat.

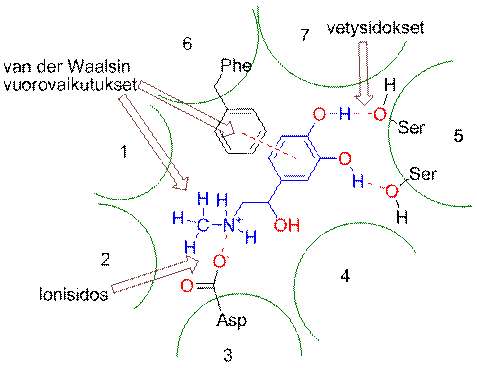
Alkaanien kiehumispisteiden riippuvuus molekyylikoosta on hyvä esimerkki van der Waalsin voimien vaikutuksesta. n-Pentaanin kiehumispiste on 36 °C ja haarautuneen 2,2-dimetyylipropaanin (neopentaanin) kiehumispiste on 10 °C. n-Pentaanimolekyylien välinen kosketuspinta on suurempi ja molekyylit pääsevät lähemmäs toisiaan kuin 2,2-dimetyylipropaanimolekyyleissä. Adrenaliini-hormoni sitoutuu beeta-adrenergiseen reseptoriin van der Waalsin voimien, vety- ja ionisidosten avulla.
| Sisällysluettelo | 2. Alkaanit | 1.14 Liukoisuus |