
Liukoisuuteen vaikuttavat liuottimen ja liuenneen aineen rakenne ja niiden väliset vuorovaikutukset (dipoli-dipoli vuorovaikutukset, Van der Waals vuorovaikutukset ja vetysidokset). Kemialliset yhdisteet liukenevat rakenteellisesti samankaltaisiin liuottimiin: polaariset (esim. pienimolekyyliset alkoholit) polaarisiin (veteen ja alkoholeihin) ja poolittomat yhdisteet (esim. bentseeni) poolittomiin liuottimiin (alkaaneihin). Polaarisen liuottimen osittaisvaraukset ovat vuorovaikutuksessa poolisten yhdisteiden osittaisvarausten kanssa, siten että liuotinmolekyylien negatiiviset poolit ympäröivät liuenneen yhdisteen positiiviset poolit ja päinvastoin. Orgaaniset molekyylit, joissa on runsaasti polaarisia ryhmiä, ovat yleensä vesiliukoisia (glyseroli, sokerit). Polaariset yhdisteet sisältävät atomeja, joiden välillä on elektronegatiivisuusero. Tällöin sidoselektronit liikkuvat lähemmäksi elektronegatiivisempaa atomia. Polaariset orgaaniset yhdisteet sisältävät yleensä vapaita elektronipareja (esim. O ja N), joilla ne pystyvät muodostamaan vetysidoksia.

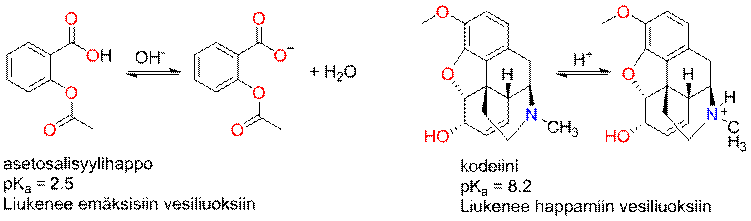
Hapoilla ja emäksillä ionisoitumisaste (pKa-arvot) ja siten (vesi)liukoisuus ovat liuottimen pH:sta riippuvaisia. Heikolla hapolla (esim. orgaaniset hapot) pH:n nousu kasvattaa liukoisuutta ja heikolla emäksellä (esim. amiinit) vaikutus on päinvastainen.
Jakautumiskertoimella (P, tai KOW) kuvataan yhdisteen jakautumista toisiinsa sekoittumattoman vesifaasin ja orgaanisen faasin välillä. Jakautumiskerroin (partition coefficient) kertoo yhdisteen liukenemisesta ja affiniteetista käytettyihin liuottimiin.
Yleensä orgaaninen faasi on oktanoli, jolloin puhutaan oktanoli-vesi jakaantumiskertoimesta. Oktanoli-vesi jakaantumiskerroin voidaan määrittää koeastiassa, jossa on vettä ja oktanolia. Koeastiaan lisätään tutkittavaa orgaanista yhdistettä, astiaa ravistetaan voimakkaasti ja tutkittavan aineen pitoisuus mitataan sekä vedestä (CW) että oktanolista (CO), ja oktanoli-vesi jakaantumiskerroin P on ko. pitoisuuksien suhde: P=CO/CW. Koska jakautumiskertoimien arvot vaihtelevat suuresti eri yhdisteillä (P = 0,0001 - 100 000), käytetään jakautumiskertoimesta yleensä logaritmista muotoa, logP. LogP arvoja voidaan myös laskea. Eräs logP-laskuohjelma löytyy osoitteesta: http://www.molinspiration.com/
Eräiden
karbamaattien oktanoli-vesi jakaantumiskertoimia (J. B. Houston et al.,
J. Pharmacol. Exp. Ther. 189, 44, 1974)
|
R-OCONH2 |
P |
log P |
|
|
Etyyli Propyyli Butyyli Pentyyli Heksyyli Heptyyli |
0.70 2.3 7.1 22.5 70.8 230 |
-0.15 0.36 0.85 1.35 1.85 2.36 |
Määritettäessä happojen ja –emästen jakautumiskertoimia tulee ottaa huomioon yhdisteiden ionisoitumisaste, joka riippuu yhdisteen pKa-arvosta ja vesifaasin pH:sta.
Jos logP < 0,5, yhdiste on vesiliukoinen,
Jos logP > 0,5, yhdiste ei liukene veteen,
Jos logP ≥ 2, yhdiste on riittävän rasvaliukoinen läpäistäkseen veri-aivoesteen (BBB = blood brain barrier)
LogP-arvo on tärkeä lääkeaineen hydrofobisuuden mitta, joka vaikuttaa mm. lääkeaineen imeytymiseen ja lääkeaine-reseptori -vuorovaikutuksiin. Lääkeaineen logP tulisi olla < 5.
| Sisällysluettelo | 2. Alkaanit |