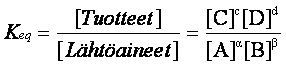
3.8 Reaktionopeus ja tasapaino
Tasapainovakio
aA + bB D cC + dD
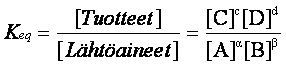
Jos Keq > 1, reaktio etenee tuotteiden suuntaan
Jos Keq < 1, reaktio etenee lähtöaineiden suuntaan
Reaktio on spontaani jos tuotteiden energia on pienempi kuin lähtöaineiden (ts. reaktio luovuttaa energiaa)
DG (Gibbsin vapaan energian muutos) kuvaa reaktion spontaanisuutta, kykyä edetä "itsestään" eteenpäin, kun DG < 0.
DG° = -RTlnKeq Keq= e-(G°/RT)
(R on yleinen kaasuvakio, T on lämpötila absoluuttisella Kelvin-asteikolla)
Gibbsin vapaan energian muutoksella on yhteys muihin energioihin.
DG° = DH° - T DS°
DS = entropia, kuvaa epäjärjestystä, joka on luonnossa aina kasvava.
DH° = entalpia - 'reaktiolämpö' kuvaa standardioloissa esimerkiksi yhdisteen energian muuttumista lämmön muutoksen avulla. DH:n ollessa negatiivinen aine antaa energiaa ulos ja sen ollessa positiivinen, aine ottaa ympäristöstä energiaa, tässä lämpöä.
Eksotermisessa reaktiossa systeemi luovuttaa lämpöenergiaa
eli entalpia pienenee, DH < 0. Energia on korkeammalla tasolla lähtöaineissa kuin tuotteissa.
Endotermisessa reaktiossa systeemi sitoo lämpöenergiaa
eli entalpia kasvaa, DH > 0. Energia on korkeammalla tasolla tuotteissa kuin lähtöaineissa.
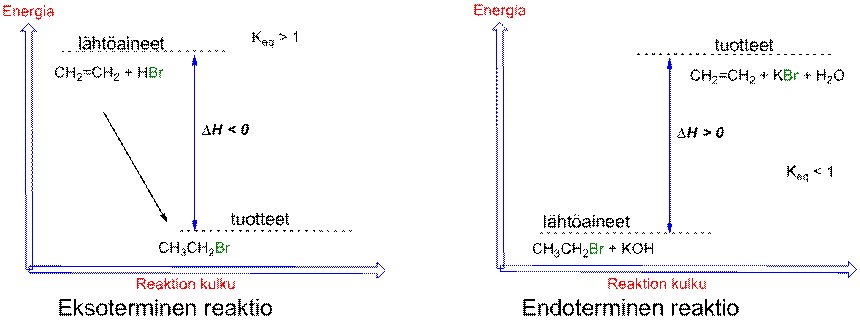
Energia muutos ja tasapainovakiot kertovat ainoastaan reaktiotasapainosta, mutta eivät kerro kuinka nopeasti tasapaino saavutetaan. Reaktion nopeuteen vaikuttaa se kuinka usein hiukkaset törmäilevät keskenään mutta myös siirtymätilan energia, jonka kautta reaktio tapahtuu. Energiamuutosta voidaan havainnollistaa reaktioenergiadiagrammilla, joka kuvaa myös reaktion nopeutta.
| Sisällysluettelo |