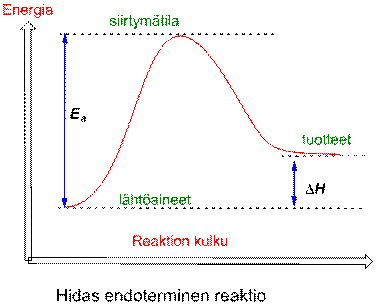
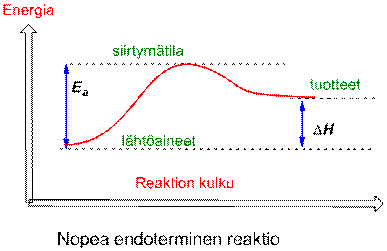
Aktivoitumisenergia ( Ea ) on se energia, joka tarvitaan käynnistämään reaktio. Käytännössä se on reaktioenergian maksimiarvo (käyrän korkein kohta). Tätä tilaa sanotaan siirtymätilaksi (Transition state). Siirtymätilan energia kertoo reaktionopeudesta eli mitä korkeampi Ea sitä hitaampi reaktio.

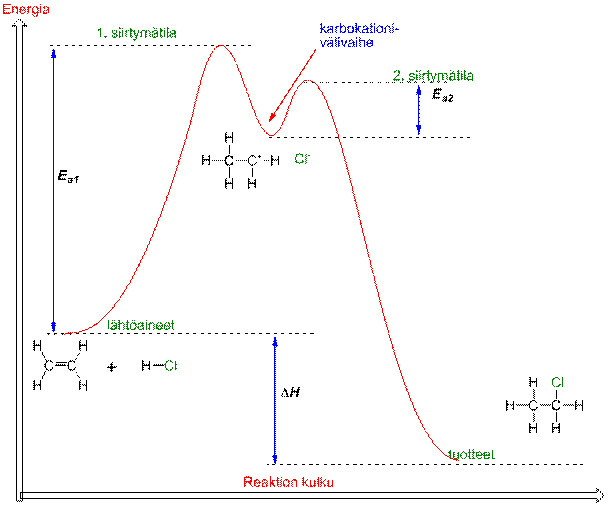
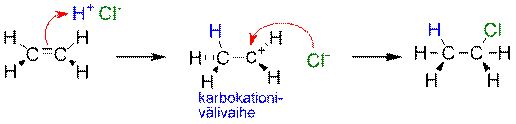
Orgaaniset reaktiot ovat usein monivaiheisia. Esim. eteenin ja HCl:n välisessä reaktiossa syntyy ensin siirtymätilan kautta karbokationi- välituote, joka reagoi välittömästi kloridi ionin kanssa kloorietaaniksi toisen siirtymätilan kautta. Reaktiolla on tällöin kaksi aktivaatioenergiaa (Ea1 ja Ea2).
Tehtävä. Piirrä yksivaiheisen, erittäin eksotermisen ja nopean reaktion energiadiagrammi. Vastaus
| Sisällysluettelo | 4. Alkeenit ja alkyynit |