Koska alkaanit sisältävät vain hiiltä ja vetyä sekä tyydyttyneitä s-sidoksia, ne reagoivat huonosti. Siksi alkaaneja sanotaan myös parafiinihiilivedyiksi (lat. parum affinis). Riittävästi kuumennettaessa alkaanit reagoivat helposti hapen kanssa, jolloin reaktiota sanotaan palamiseksi. Palamisen lopputuotteena saadaan hiilidioksidia ja vettä. Samalla vapautuu runsaasti energiaa.
CH4 + 2 O2 " CO2 + 2 H2O + energiaa
Alkaanit ovat tärkeitä polttoaineita ja energian lähteitä. Maakaasu ja maaöljy koostuvat pääosin alkaaneista.
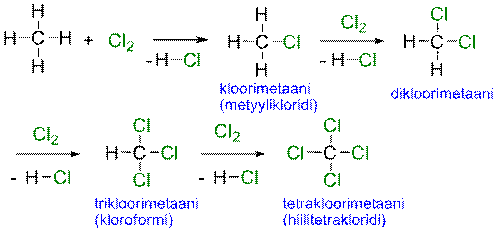
Alkaanit reagoivat halogeenien esim. kloorin kanssa, jolloin alkaanin vety korvautuu halogeenilla ja saadaan halogenoitujen alkaanien seos. Tällaista reaktiota sanotaan halogenoinniksi. Esim. metaania kloorattaessa saadaan metyylikloridin (CH3Cl), dikloorimetaanin (CH2Cl2), trikloorimetaanin (CHCl3) ja tetrakloorimetaanin (CCl4) seos:

Alkaanit ovat poolittomia ja kemiallisesti inerttejä. Ne eivät liukene veteen. Nestemäiset alkaanit ovat hyviä liuottimia kuten heksaani tai petrolieetteri, joka on alkaanien seos. Pienimolekyyliset alkaanit butaaniin saakka ovat kaasuja, loput nesteitä heptadekaaniin saakka. Mitä haarautuneempi hiiliketju on, sitä alhaisempi on alkaanin kiehumispiste.
|
hiiliatomien lukumäärä |
nimi |
kaava CnH2n+2 |
kiehumispiste °C |
|
1 |
metaani |
CH4 |
- 162 |
|
2 |
etaani |
C2H6 |
- 89 |
|
3 |
propaani |
C3H8 |
- 42 |
|
4 |
butaani |
C4H10 |
- 0,5 |
|
5 |
pentaani |
C5H12 |
36 |
|
5 |
2,2-dimetyyli-propaani |
C5H12 |
10 |
|
6 |
heksaani |
C6H14 |
69 |
|
6 |
2-metyyli-pentaani |
C6H14 |
60 |
|
8 |
oktaani |
C8H18 |
126 |
|
10 |
dekaani |
C10H22 |
174 |
| Sisällysluettelo | 2.5 Etaanin konformaatiot |