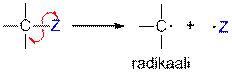
A:B "A• + • B
Homolyyttinen sidoksen katkeaminen (radikaalimekanismi), jossa muodostuu reaktiotuotteena radikaaleja
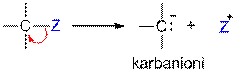
A:B "A+ + :B-
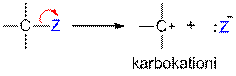
Heterolyyttinen sidoksen katkeaminen (polaarinen mekanismi). Hiilestä voi tällöin muodostua karbokationi tai karbanioni
Tapaa, jolla reaktio tapahtuu, sanotaan reaktiomekanismiksi. Reaktiomekanismista selviää reaktion eri vaiheet, funktionaalisissa ryhmissä tapahtuvat elektronien siirtymiset, sidosten avautumiset, katkeamiset ja syntymiset, välituotteet sekä lopputuotteet.
Reaktiossa elektronien siirtyminen johtaa sidoksen katkeamiseen tai syntymiseen. Sidos katkeaa homolyyttisesti (radikaali-mekanismi), kun sidoselektronit siirtyvät kummallekin sidosatomille (syntyy radikaaleja), ja heterolyyttisesti (polaarinen mekanismi), kun sidoselektronit jäävät toiselle sidosatomille, jolloin atomit varautuvat sähköisesti (muodostuu anioni ja kationi).
| A:B "A• + • B
|
Homolyyttinen sidoksen katkeaminen (radikaalimekanismi), jossa muodostuu reaktiotuotteena radikaaleja
|
|
A:B "A+ + :B-
|
Heterolyyttinen sidoksen katkeaminen (polaarinen mekanismi). Hiilestä voi tällöin muodostua karbokationi tai karbanioni
|
Jos kumpikin atomi luovuttaa elektronin elektroniparia varten, sidos syntyy homogeenisesti ja heterogeenisesti, kun elektronit tulevat vain toiselta sidosatomilta:
A• + • B " A:B Homogeeninen sidoksen muodostuminen (radikaalimekanismi)
A+ + :B- "A:B Heterogeeninen sidoksen muodostuminen (polaarinen mekanismi)
Radikaalit ovat erittäin reaktiokykyisiä, sähköisesti neutraaleja, parittomia elektroneja sisältäviä atomeja tai molekyylejä, jotka pyrkivät täydentämään elektroniverhonsa oktetiksi. Ne ottavat vastaan toisen atomin tai atomiryhmän parittoman elektronin ja muodostavat sidoksen homogeenisesti. Elektroni voidaan ottaa myöskin sidoksesta, jolloin muodostuu uusi radikaali ja reaktio voi jatkua ketjureaktiona.
Rad• + A:B " Rad:A + • B
radikaali substituutiotuote uusi radikaali
Polaarinen reaktio
Polaarinen reaktio on tyypillinen yhdisteille, joissa varaukset ovat jakautuneet epätasaisesti. Funktionaalinen ryhmä polaroituu ts. sen elektronegatiiviset atomit varautuvat negatiivisesti ja elektropositiiviset positiivisesti. Elektronegatiivinen alkuaine, kuten happi, typpi tai halogeeni vetää sidoselektroneja puoleensa ja varautuu lievästi negatiivisesti (d-), samalla kun hiiliatomi saa yhtä suuren positiivisen varauksen (d+).
Jos hiileen liittyy elektropositiivisempi alkuaine (esim. Mg, Li, Na, Pb), tämä varautuu lievästi positiiviseksi (d+) ja hiili lievästi negatiiviseksi (d-). Esimerkiksi Grignardin reagenssissa (organometalliyhdiste) magnesium varautuu positiivisesti ja hiiliatomi lievästi negatiivisesti. Yhdisteen positiivisesti varautunutta osaa sanotaan elektrofiiliksi (elektronihakuiseksi) ja negatiivisesti varautunutta osaa nukleofiiliksi (ydinhakuiseksi).
Polaarisessa reaktiossa funktionaalisen ryhmän nukleofiilinen (negatiivisesti varautunut) osa liittyy kahden elektroninsa avulla reagenssin positiivisesti varautuneeseen atomiin ja elektrofiilinen osa taas reagenssin negatiivisesti varautuneeseen atomiin. Koska sidoselektronit tulevat vain toiselta atomilta, sidos syntyy heterogeenisesti.
Tehtävä. Osoita seuraavien yhdisteiden polaarisuus. Mikä kohta yhdisteissä on elektrofiilinen, mikä taas nukleofiilinen?
(a) Asetoni, CH3COCH3
(b) Butyylilitium, CH3CH2CH2CH2-Li
(c) Kloorietaani, CH3CH2Cl
(d) Metaanitioli, CH3SH
(e) Etyyni, HCºCH
| Sisällysluettelo |
3.6 Esimerkki polaarisesta reaktiosta: HCl:n additio eteeniin |